Novo tratamento para carcinoma de células renais avançado
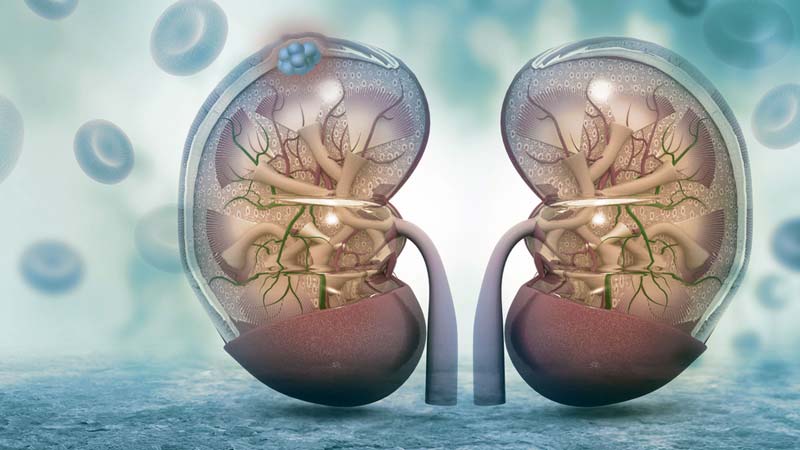
A Merck e a Pfizer anunciaram hoje que a Agência de Alimentos e Medicamentos dos EUA aprovou um novo fármaco para o combate ao carcinoma de células renais avançado.
A Merck e a Pfizer anunciaram hoje que a Agência de Alimentos e Medicamentos dos EUA (Food and Drug Administration – FDA) aprovou BAVENCIO (avelumab) em combinação com axitinib para o tratamento em primeira linha de doentes com carcinoma de células renais (CCR) avançado. Trata-se da primeira aprovação concedida pela FDA a uma terapêutica anti-PD-L1 como parte de um regime de tratamento em associação destinado a doentes com CCR avançado. A aprovação de BAVENCIO em combinação com axitinib foi baseada nos resultados positivos do estudo de Fase III JAVELIN Renal 101, que demonstraram que a combinação aumentou significativamente a mediana da sobrevivência livre de progressão (PFS), comparativamente a sunitinib, em mais de 5 meses, na população com intenção de tratar (ITT) (HR: 0,69 [IC 95%: 0,56-0,84]; valor p bilateral=0,0002; mediana de PFS para BAVENCIO em combinação com axitinib: 13,8 meses [IC 95%: 11,1-NE]; sunitinib: 8,4 meses [IC 95%: 6,9-11,1]). A população ITT incluiu doentes independentemente da expressão de PD-L1 e doentes com diferente prognóstico de acordo com o IMDC (International Metastatic Renal Cell Carcinoma Database): favorável: 21%; intermédio: 62%; e desfavorável: 16%.
“Como pretendemos continuar a melhorar os resultados do tratamento de pessoas com CCR avançado, deparamo-nos com novas abordagens terapêuticas com potencial para proporcionar benefícios aos doentes”, afirmou Robert J. Motzer, M.D., Diretor de Oncologia Clínica do Memorial Sloan Kettering Cancer Center da Fundação Jack e Dorothy Byrne, Nova Iorque, EUA, e investigador principal do estudo JAVELIN Renal 101. “A aprovação recebida hoje pela FDA para a combinação de avelumab e axitinib permite-nos agora oferecer uma opção de tratamento em primeira linha aos doentes com CCR avançado que combina uma imunoterapia anti-PD-L1 com um inibidor do EGFR amplamente conhecido, de forma a proporcionar uma redução significativa do risco de progressão da doença ou morte, assim como duplicar a taxa de resposta, comparativamente a sunitinib”.
O CCR constitui um tipo de carcinoma em que a expressão de PD-L1 poderá contribuir para a inibição da resposta imune ao tumor. Trata-se ainda de um tumor extremamente vascularizado, em que o fator de crescimento endotelial vascular (VEGF) desempenha um papel fundamental.
“Um diagnóstico de cancro renal constitui um evento com enorme impacto na vida dos doentes e dos seus entes queridos, pelo que a existência de uma estratégia adequada de tratamento se torna rapidamente numa prioridade”, afirmou Dena Battle, Presidente da KCCure. “A aprovação de novos tratamentos, tais como a combinação de BAVENCIO e axitinib, disponibiliza opções terapêuticas necessárias aos doentes com CCR avançado”.
Existe uma necessidade clínica não satisfeita de tratamentos em primeira linha capazes de atrasar a progressão da doença e com um perfil de segurança tolerável. Aproximadamente 20% a 30% dos doentes com CCR são diagnosticados pela primeira vez no estádio avançado. Além disso, 30% dos doentes que recebem tratamento em fases mais precoces desenvolvem metástases. Cerca de metade dos doentes com CCR avançado não recebem terapêutica adicional após o tratamento de primeira linha, por motivos que podem incluir um performance status desfavorável ou a ocorrência de eventos adversos relacionados com tratamento inicial.
“A aprovação hoje recebida para a combinação de BAVENCIO e axitinib vem consolidar a longa tradição da Pfizer em disponibilizar inovação à comunidade de doentes com CCR. Temos a esperança de ser capazes de ter um impacto significativo e fazer a diferença na vida dos doentes”, afirmou Andy Schmeltz, Presidente Global da Pfizer Oncology. “Há mais de 12 anos que a Pfizer tem vindo a liderar nesta área, graças ao seu empenho em desenvolver novas opções de tratamento para os doentes com cancro renal avançado”.
“Senti-mo-nos privilegiados por sermos capazes de disponibilizar uma nova opção terapêutica em primeira linha aos doentes com carcinoma de células renais avançado”: afirmou Rehan Verjee, Presidente da EMD Serono, a área de negócios Biofarmacêutica da Merck nos EUA, e Diretor Global de Franchising de Medicina Inovadora da Merck.
No estudo JAVELIN Renal 101, a taxa de resposta objetiva (ORR) duplicou na população ITT tratada com BAVENCIO em combinação com axitinib versus sunitinib (51,4% [IC 95%: 46,6-56,1] vs. 25,7% [IC 95%: 21,7-30,0]). Com uma mediana de follow up para sobrevivência global (OS) de 19 meses, os resultados do ensaio clínico relativos a este outro endpoint final de eficácia primária foram considerados imaturos, tendo sido observada uma taxa de eventos mortais de 27% na população ITT, prosseguindo o ensaio de acordo com o planeado. As reações adversas mais frequentes (≥20%) foram diarreia, fadiga, hipertensão, dores músculo-esqueléticas, náuseas, mucosite, eritrodisestesia palmar-plantar, disfonia, diminuição do apetite, hipotiroidismo, erupção cutânea, hepatotoxicidade, tosse, dispneia, dores abdominais e cefaleias. Foi observada a ocorrência de reações adversas graves em 35% dos doentes tratados com a combinação de BAVENCIO e axitinib. A incidência de eventos adversos cardiovasculares graves (EACG) foi superior com BAVENCIO em combinação com axitinib versus sunitinib. Os resultados do estudo foram publicados no The New England Journal of Medicine.
A Agência Europeia do Medicamento (EMA) validou o pedido de alteração de Tipo II para BAVENCIO em combinação com axitinib no tratamento do CCR avançado em Março de 2019, tendo sido ainda submetido um pedido complementar para BAVENCIO em combinação com axitinib no tratamento do CCR não ressecável ou metastático no Japão, em Janeiro de 2019. A combinação de BAVENCIO e axitinib apenas se encontra aprovada para o tratamento em primeira linha do CCR avançado nos Estados Unidos.