Brazil autoriza testes de duas vacinas contra a Covid-19
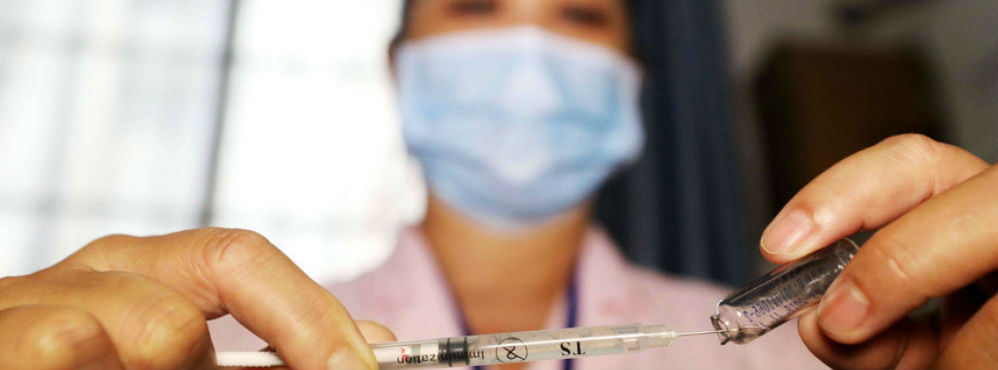
O Governo brasileiro autorizou um ensaio clínico no país para o desenvolvimento de duas vacinas contra a covid-19, criadas pela farmacêutica norte-americana Pfizer e pela empresa alemã BioNTech
A autorização foi concedida pela Agência Nacional de Vigilância Sanitária (Anvisa), órgão de controlo tutelado pelo Governo brasileiro, e divulgada no Diário Oficial da União.
Em comunicado, a Anvisa refere que as vacinas em estudo, designadas BNT162b1 e BNT162b2, “são baseadas em ácido ribonucleico (RNA), que codifica um antígeno específico do vírus Sars-CoV-2”. O RNA “é traduzido pelo organismo humano em proteínas que irão então induzir uma resposta imunológica“, adianta.
Os testes das vacinas da Pfizer e BioNTech preveem a inclusão de cerca de 29 mil voluntários, sendo 1.000 no Brasil, distribuídos pelos estados de São Paulo e Bahia. O recrutamento dos voluntários é de responsabilidade dos centros que vão desenvolver a investigação.
Ensaio clínico é composto por três fases
Os testes aos medicamentos desenvolvidos pelo consórcio da Pfizer com a BioNTech farão parte do terceiro estudo para vacinas contra a covid-19 em desenvolvimento no Brasil, que também está a ajudar a testar um imunizante produzido pela Universidade de Oxford e a empresa farmacêutica AstraZeneca, e outra vacina desenvolvida pelo laboratório chinês Sinovac.
Os testes do medicamento desenvolvido pelos cientistas de Oxford começaram em junho no país sul-americano, que deverá realizar cinco mil testes em voluntários, numa parceria que envolve a organização brasileira Fundação Oswaldo Cruz (Fiocruz).
A vacina da Sinovac, que será aplicada em nove mil voluntários, já está a ser testada em São Paulo. Os testes são coordenados pelo Instituto Butantan, uma instituição científica que produz vacinas há mais de um século.
Metade dos voluntários desta vacina, chamada CoronaVac, receberão duas doses do imunizante a partir desta semana, a outra metade receberá um placebo.
SO/LUSA