Farmacêutica assegura que suspensão temporária do contracetivo não está relacionada com segurança do produto
A farmacêutica Bayer, que comercializa o contracetivo "Essure", retirado do mercado espanhol durante três meses, assegurou hoje que "esta suspensão temporária não está relacionada com qualquer questão de segurança ou de qualidade do produto"
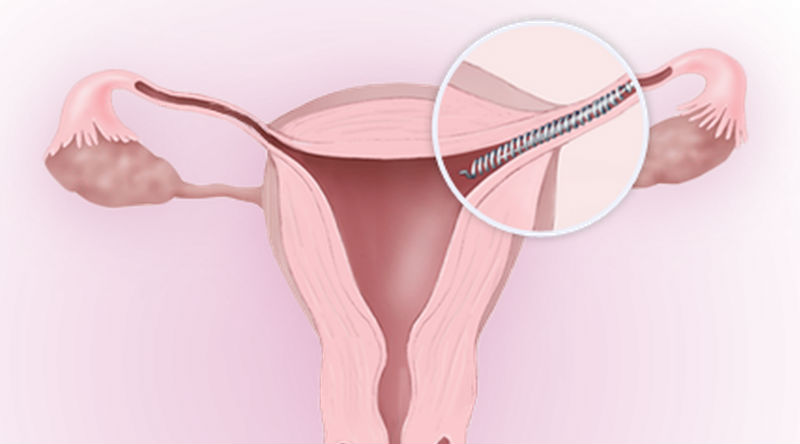
A Agência Espanhola dos Medicamentos e Produtos de Saúde (AEMPS) requereu a retirada do mercado do método contracetivo “Essure”, por este não dispor atualmente do certificado CE e como medida de precaução ordenou aos serviços de saúde que parem de o utilizar.
A AEMPS foi informada pela empresa Bayer Hispania da suspensão temporária do certificado CE a este produto até 2 de novembro, emitido pela National Standards Authority of Ireland (NSAI).
Muitos produtos só podem ser vendidos na União Europeia se ostentarem a marcação CE, que certifica que os mesmos foram avaliados e cumprem os requisitos da UE em matéria de segurança, saúde e proteção do ambiente.
Numa nota emitida na segunda-feira, a AEMPS explica que o “Essure” é um anticoncecional permanente e que atua de forma mecânica, provocando uma reação de corpo estranho que produz a oclusão da trompa.
Na mesma nota, a agência espanhola refere que, por não ter atualmente o certificado CE em vigor, foi requerida a sua retirada do mercado.
Hoje a empresa Bayer explicou em comunicado que a National Standards Authority of Ireland decidiu não renovar o certificado porque “não encerrou o processo de recertificação do produto antes da data em que este expirava, a 3 de agosto”.
Assim, explica a empresa, a comercialização do Essure tem de ser suspensa temporariamente nos mercados onde é distribuído com a marcação CE, entre os quais Espanha.
Esta suspensão temporária, adianta a Bayer, não afeta mercados como o dos Estados Unidos.
De momento, enquanto aguardam a resolução de todas as questões pendentes associadas ao processo de recertificação, a AEMPS solicitou à Bayer essa suspensão temporária de comercialização e a retirada do mercado do dispositivo “Essure”.
A Bayer salienta que a agência espanhola observou que os dados existentes “não questionam a relação benefício / risco do dispositivo”.
Quanto às mulheres que já têm o Essure, a AEMPS refere que “não aconselha a sua remoção ou a alteração da sua monitorização”.
A empresa afirma ainda que “a segurança do paciente e o uso adequado do “Essure” é a principal prioridade para a Bayer”.
A agência Lusa contactou o INFARMED (Instituto da Farmácia e do Medicamento) português para questionar se este dispositivo é comercializado em Portugal e se a sua licença será retirada provisoriamente, como aconteceu em Espanha, mas aquele organismo remeteu uma resposta para mais tarde.
LUSA/SO/SF